Le chlorure de chromyle est un composé inorganique de la famille des oxychlorures, de formule CrO2Cl2. Il se présente sous la forme d'un liquide rouge sang foncé, opaque dans les conditions normales de température et de pression. Il fume également en présence d'humidité.
Propriétés
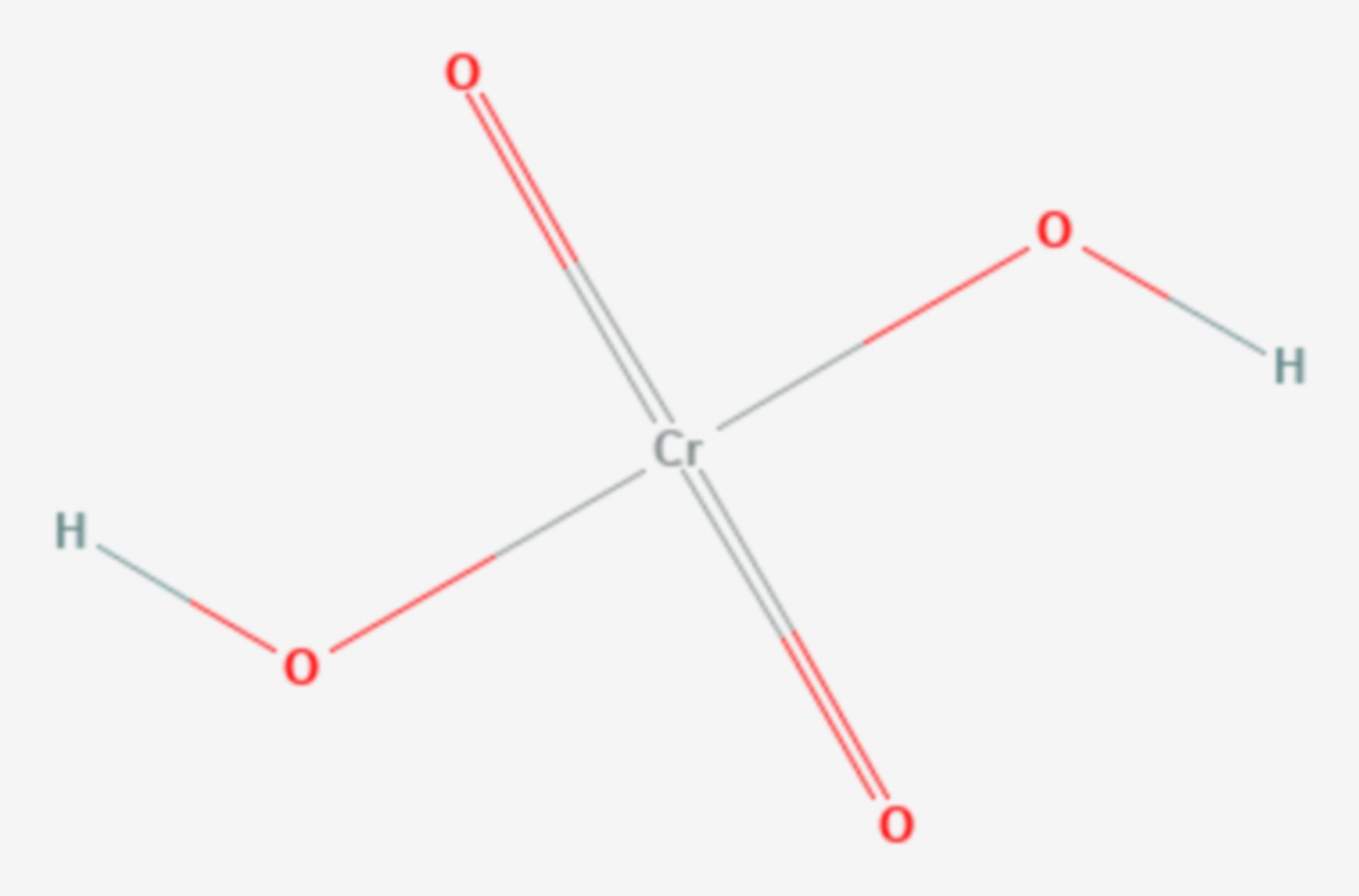
Le chlorure de chromyle possède une géométrie moléculaire tétraédrique, assez proche de celle du chlorure de sulfuryle (SO2Cl2) et de celle du plus commun des composés de chrome(VI), l'ion chromate ([CrO4]2−). Si ce dernier et le chlorure de chromyle partagent une structure similaire et le fait d'être tous les deux des composés du chrome(VI), leurs autres propriétés diffèrent assez largement. Tout d'abord le chlorure de chromyle est un liquide et une molécule neutres, alors que le chromate est une espèce ionique qui a tendance à former des sels. De plus, CrO2Cl2 est un oxydant bien plus fort que [CrO4]2−, ce qui peut être mis sur le compte de la nature anionique de ce dernier, ce qui réduit son affinité électronique. Le chlorure est aussi un moins bon donneur π que l'oxyde.
CrO2Cl2 étant une espèce moléculaire neutre, ses différentes molécules, tant à l'état liquide qu'à l'état solide, interagissent principalement par des forces de Van der Waals. La faiblesse de telles liaisons est la cause de ses bas points de fusion et d'ébullition, et font que le chlorure de chromyle est un liquide pouvant être distillé.
Le chlorure de chromyle se décompose violemment en présence d'eau, dégageant en particulier du chlorure d'hydrogène. Il tend aussi à se décomposer lorsqu'il est chauffé. Il présente des risques d'explosion en présence de chlore, d'azoture de sodium, de phosphore en conditions humides et plus rarement en présence de trichlorure de phosphore. Il réagit dangereusement avec les hydrures, l'ammoniac, l'urée, le soufre et ses composés, comme le disulfure d'hydrogène, le sulfure de calcium ou le dichlorure de soufre, le tribromure de phosphore, le chlorure de phosphoryle, les substances combustibles, les substances organiques en général et les hydrocarbures en particulier, les réducteurs, et un grand nombre de solvants incluant l'eau, l'acétone, l'éther diéthylique, l'éthanol, le glycol, les hydrocarbures halogénés, le méthanol, la pyridine...
CrO2Cl2 est hautement électrophile et un oxydant agressif, étant par exemple capable de provoquer des combustions spontanées par simple contact avec du soufre amorphe. Il peut aussi oxyder le toluène en benzaldéhyde. Sa forte électrophile peut être démontrée par son hydrolyse rapide donnant de l'acide chromique et de l'acide chlorhydrique :
- CrO2Cl2 2H2O → H2CrO4 2HCl
Synthèse
CrO2Cl2 peut être synthétisé par réaction entre le chlorure d'hydrogène et le trioxyde de chrome :
- CrO3 2 HCl → CrO2Cl2 H2O
Il peut aussi être produit par réaction entre l'acide sulfurique et chromate de potassium (K2CrO4), suivie par une réaction avec le chlorure de sodium et le dichromate de potassium, puis être obtenu par une distillation douce.
- K2Cr2O7 4 NaCl 6H2SO4 → 2 CrO2Cl2 2 KHSO4 4 NaHSO4 3 H2O
Utilisation
Test de la présence de chlorures
Le test du chlorure de chromyle consiste à chauffer un échantillon suspecté de contenir des chlorures avec du dichromate de potassium et de l'acide sulfurique concentré. Si un chlorure est présent, du chlorure de chromyle se forme, sa présence étant indiquée par la formation de fumée rouge. En cas contraire, il n'y a évidemment pas de fumée rouge. Aucun composé analogue n'est formé en présence de fluorure, de bromure, d'iodure ou de cyanure, ce test est donc spécifique aux chlorures.
Oxydation des alcènes
Selon les solvants, CrO2Cl2 oxyde les alcènes terminaux en aldéhydes. Les alcènes internes donnent eux des alpha-chlorocétones ou des dérivés proches.
CrO2Cl2 attaque aussi les groupes méthyles benzyliques pour former des aldéhydes via la réaction d'Étard.
Autres
CrO2Cl2 peut aussi être utilisé pour tester l'absence d'ions nitrate.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Chromyl chloride » (voir la liste des auteurs).
- Portail de la chimie


![Chlor • einfach erklärt, Eigenschaften, Verwendung · [mit Video]](https://d3f6gjnauy613m.cloudfront.net/system/production/videos/003/182/1a6f8d40458c8d7b44021deebff33c7a6a4e6ad0/Thumbnail_Chlor.png?1683199467)
